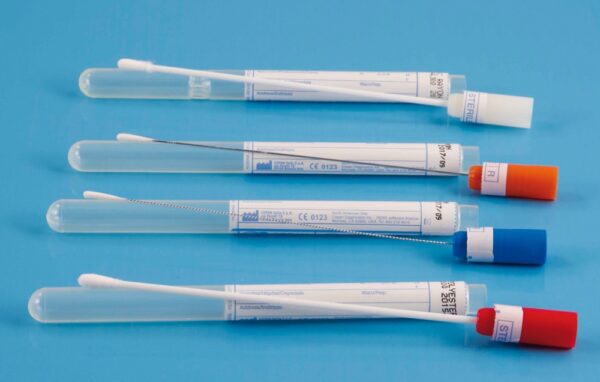
Este acto, el de recoger una muestra del lecho de una herida que no responde a nuestro tratamiento, viene siendo habitual en nuestro quehacer diario, pero cabe preguntarse: ¿lo realizamos correctamente según las guías de práctica clínica?.
A través de esta entrada pretendemos aclarar aspectos a tener en cuenta para seguir manteniendo a raya la «variabilidad clínica». De modo que lo primero que hemos de tener claro es:
¿Cuándo puede estar recomendado la toma de muestra de una herida?
Lo ideal en todo caso sería plantearse la toma de muestra en una herida cuando tenemos la sospecha de que existe una infección y a poder ser, antes de comenzar con un tratamiento empírico de antibióticos. De modo que no debemos de olvidar cuáles son los signos típicos de una herida infectada:
- Dolor
- Calor
- Rubor
- Tumefacción
- Mal olor
- Presencia de exudado, que puede ser seroso, sero-purulento, hemo-purulento o purulento
- Presencia de celulitis
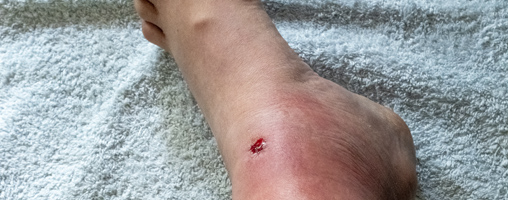
En el caso de que ya se haya iniciado un tratamiento empírico de antibióticos de amplio espectro y no se vea mejoría podemos estar ante la presencia de bacterias resistentes, siendo recomendable realizar una toma de muestra para un cultivo (no es necesario suspender el tratamiento antibiótico).
En caso de heridas crónicas podríamos tener en cuenta otra serie de características que también nos van a aportar información sobre la posibilidad de infección y por ello podríamos pensar en una toma de muestras para cultivo:
- La herida no evoluciona, está empeorando o está aumentando su tamaño
- Existe tejido de granulación friable
- Cambio en el olor habitual
- Cambios en las características del exudado
- Aparición de edema perilesional
- Cambios en el color del lecho de la herida
RECIPIENTES PARA TOMA Y ENVÍO DE MUESTRAS
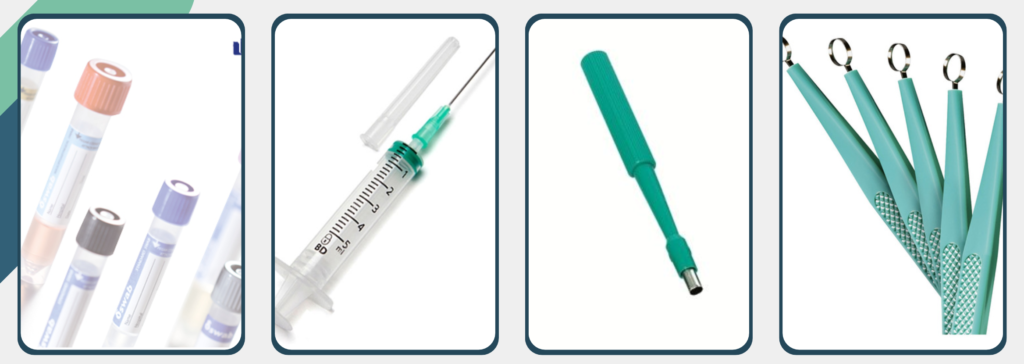
- Hisopo Estéril: normalmente se acompañan de un medio de transporte tipo Stuart-Amies , que es específico para microorganismos anaerobios y suelen ser de alginato cálcico.
- Jeringas de aspirado: usadas cuando realizamos una toma de muestra por punción o aspirado, sobre todo cuando se toman muestras en muy poca cantidad. Si retiramos el aire, cerramos con tapón estéril y se va a procesar de forma inmediata podemos utilizar este recipiente para cultivo de anaerobios.
- Contenedores estériles de boca ancha: hemos de tener la precaución de que se adapten bien al tamaño de la muestra y que mantengan condiciones adecuadas de humedad.
- Viáles específicos con atmósfera anaeróbia: su medio de transporte es semisólido.
MANTENIMIENTO PARA SU ENVÍO
Podremos mantener a temperatura ambiente las muestras si se va a enviar a laboratorio en las 2 horas siguientes a su toma. Si hemos de esperar al día siguiente podremos conservar en la nevera
MÉTODOS PARA LA RECOGIDA DE MUESTRAS
Hisopo o torunda

Probablemente sea uno de los métodos más utilizados pero no es el ideal para cultivo. Al utilizarse en heridas abiertas presenta un valor diagnóstico algo dudoso debido que al recoger la muestra del lecho de la herida lo haremos de microorganismos que están en superficie, los cuales no tienen por qué ser los patógenos causantes de la infección.
Ante la presencia de biofilm en el lecho podemos encontrarnos con resultados negativos aún existiendo infección, por lo que si existen sospechas de su existencia deberíamos descartar este método de toma de muestras.
El hecho de ser un método de recogida de muestras barato, sencillo de realizar y no invasivo nos lleva a elegirlo como primera opción, por lo que es importante hacer una buena valoración de la herida para determinar si es adecuado o no su elección.
Material:
- Gasas estériles
- Guantes estériles
- Suero fisiológico
- Cureta / bisturí
- Pinzas sin dientes
- 2 torundas con medio de transporte tipo Stuart-Amies
Método:
- Retirada del apósito
- Limpieza de la herida con suero fisiológico (podemos ayudarnos de una jeringa)
- Realizar desbridamiento o retirada de biofilm si es necesario
- Limpieza de la herida con suero fisiológico
- Toma de muestra mediante la Técnica de Levine:
- Rotar el hisopo por un área de la herida de 1 cm2 con la presión suficiente para extraer fluidos, sin llegar al sangrado. Seguimos con la toma de muestras seriadas en varias zonas de la herida, siguiendo el sentido de las agujas del reloj, por ejemplo.
- Tomaremos las muestras con dos hisopos, uno para inocular el medio de cultivo y otro la para la tinción de gram.
- Evitar siempre recoger pus
Punción / aspiración:
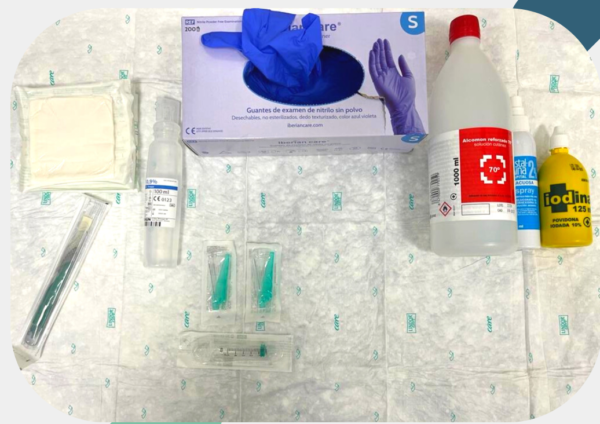
Es considerado el mejor método de detección de bacterias, especialmente anaerobias; es sencillo y fácil de llevar a cabo. Por ello se recomienda su uso por encima del hisopo.
Material:
- Gasas estériles
- Guantes, preferiblemente estériles
- Alcohol etílico o isopropílico de 70º
- Antisépticos (Povidona iodada al 10% o Clorhexidina al 2%)
- Jeringa estéril de 5cc
- 2 agujas IM (0,8 x 40
- Suero fisiológico al 0,9%
- Cureta / bisturí
- Medio de transporte
Método:
- Retirar apósito que cubre la herida
- La punción se realiza a través de la piel integra de la piel periulceral, seleccionando el lado de la lesión con mavor presencia de tejido de granulación, ausencia de necrosis o esfacelos.
- Limpiar de forma concéntrica esa zona de punción con alcohol etílico o isopropílico al 70%
- Aplicar el antiséptico elegido y esperar el tiempo recomendado, 3 min para la povidona y 30 seg para la clorhexidina.
- Realizar una punción-aspiración con la jeringa y aguja manteniendo una inclinación aproximada de 45º en dirección al borde o pared de la lesión. El volumen óptimo de aspirado se establece entre 1 y 5 ml
- En procesos no supurativos, completar la aspiración con 0,5ml o 1 ml de suero fisiológico. En este caso es recomendable anotar en la petición cuánto hemos añadido de SSF.
- Una vez realizada la aspiración, se debe expulsar el aire de la jeringa, tapando la aguja con una gasa estéril impregnada en alcohol para eliminar el riesgo de aerosoles.
- A continuación, se debe cambiar la aguja por otra estéril e inocular el contenido, previa desinfección del tapón de goma, en un vial de transporte para anaerobios. Si se carece de este medio de transporte, alternativamente, se puede tapar el cono de la jeringa con un tapón, utilizar una aguja, sin utilizar, con su capuchón correspondiente, asegurarlo bien y enviar así la muestra al laboratorio lo antes posible.
- No es necesario refrigerar pero sí protegerlo de la luz (2 a 25ºC)
Biopsia:

Es el procedimiento de toma de muestras con mayor nivel diagnóstico, incluso cuando existe la presencia de biofilm. Se lleva a cabo exclusivamente en la atención especializada y es un método más cruento e invasivo, que daña el lecho de la herida.
Material:
- Gasas estériles
- Guantes, preferiblemente estériles
- Suero fisiológico
- Antiséptico (Povidona iodada al 10 % o Clorhidrato de Clorhexidina al 2%)
- Contenedor estéril de plástico con tapón de rosca
- Pinza de disección sin dientes
- Bisturí n° 18
- Punch de 5 mm
Método:
- Retirar apósito que cubre la herida
- Limpieza de la herida con suero fisiológico.
- Antisepsia (Povidona iodada al 10 % o Clorhidrato de Clorhexidina al 2%)
- Desbridamiento cortante de restos necróticos y esfacelos, si fuese necesario
- Si se desbrida, volver a aplicar suero fisiológico y secar con gasa
- Tomar dos muestras de distinto sitio de la herida con el punch.
- Introducir las muestras en el contenedor estéril, añadir unas gotas de suero fisiológico para evitar la desecación, asegurarse que queda bien cerrado.
Recogida con presencia de biofilm:
Material:
- Gasas estériles
- Guantes, preferiblemente estériles
- Suero fisiológico
- Antiséptico (Povidona iodada al 10 % o Clorhidrato de Clorhexidina al 2%)
- Contenedor estéril de plástico con tapón de rosca
- Pinza de disección sin dientes
- Preferiblemente, curéter o cureta. Si no es posible, bisturí o tijeras
Método:
- Retirar apósito que cubre la herida
- Limpieza de la herida con suero fisiológico
- Antisepsia (Povidona iodada al 10 % o Clorhidrato de Clorhexidina al 2%)
- Desbridamiento cortante con bureta o bisturí de la zona con sospecha de biofilm
- Posteriormente, volver a limpiar con SSF y realizar antisepsia
- Introducir las muestras en el contenedor estéril, añadir unas gotas de suero fisiológico para evitar la desecación, asegurarse que queda bien cerrado